杭州医学院陈达之在国际权威期刊《Engineering》发表关于肠道聚合免疫球蛋白受体(pIgR)通过STAT3途径调控肠道菌群内稳态机制改善自身免疫性肝炎研究中取得新进展
2024年1月20日,杭州医学院临床医学院陈达之副研究员联合浙江省慢性肝病重症化精准诊治与转化重点实验室(温医大附一医肝病中心)在国际权威期刊《Engineering》(中科院TOP一区,IF=12.8)发表题为“STAT3-Dependent Effects of Polymeric Immunoglobulin Receptor in Regulating Interleukin-17 Signaling and Preventing Autoimmune Hepatitis”的研究论文。该研究首次发现自身免疫性肝炎(AIH)肠道聚合免疫球蛋白受体(pIgR)通过STAT3途径上调白介素17D的表达,促进固有淋巴细胞3群分化与抗菌肽Reg3b的表达,维持肠道菌群内稳态,在改善自身免疫性肝脏炎症取得突破性进展。这是继该科研团队报道肠道pIgR参与自身免疫性肝炎“肠-肝”轴调控后(Cell Death Dis. 2023 May 2;14(5):300),针对肠道pIgR自身免疫性肝炎中的作用与机制的又一重要发现。陈达之副研究员作为论文的末位通讯作者,温医大2020级硕士研究生李婷为第一作者,杭州医学院为第二通讯单位。

自身免疫性肝炎(AIH)发病机制尚不明确,且由于最初的临床症状与病毒性肝炎症状相似,临床上诊断比较困难。因此,准确及时地监测出AIH的特异性指标无疑对诊断以及进一步治疗具有重要意义。肠道菌群失衡与AIH的发生发展相关,目前发现AIH患者的肠道菌群失衡表现为肠道菌群多样性降低,且总体菌群结构和健康人群有所不同。
本研究首先收集了来自于温医大附一院的15例AIH患者粪便,发现AIH患者的粪便微生物群多样性下降。AIH患者与健康对照者相比,Bacteroides、Prevotella、Blautia和Fecalibacterium的相对丰度增加,而Akkermansia和Lactobacillus的相对丰度降低。采用PCR和ELISA检测粪便pIgR水平,结果显示AIH患者的粪便pIgR浓度明显高于健康对照组。为了研究AIH患者中pIgR表达与疾病相关属之间的关系,我们进行了部分Spearman 's基于秩的相关检验(图1(d))。在属水平上,pIgR的表达与17个分类群的丰度相关。例如,Enterococcus和Bacteroides属的丰度与pIgR表达呈正相关,而Barnesiella、Akkermansia和Fecalibacterium的丰度则呈负相关。图1(e)显示Pearson相关分析结果,显示pIgR与用于评估AIH损害程度的宿主因子(ALT、AST、IgG)呈正相关。
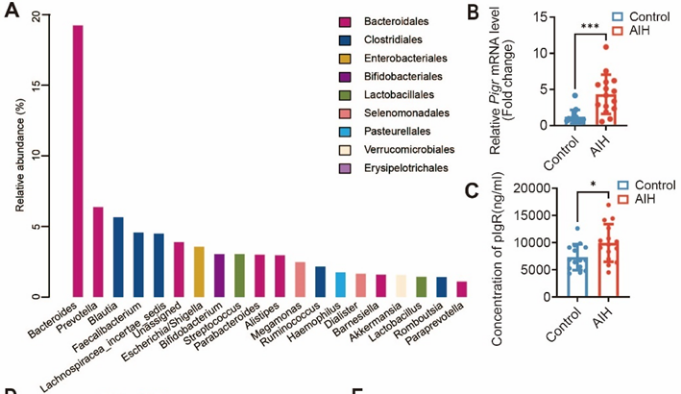
图1 AIH患者肠道菌群紊乱和粪便pIgR水平升高。(a)属级物种总体丰度的直方图。(b)人粪便中Pigr mRNA水平的比较分析。*** p < 0.001。(c)人粪便中产生pIgR的ELISA检测。* p < 0.05。
同时建立了刀豆蛋白A (ConA)诱导的急性病程动物模型,发现随着肝损伤严重程度的增加,肝脏中pIgR水平没有明显变化,而肠道组织中pIgR水平显著升高。通过使用Pigr基因敲除(KO)小鼠模型和ConA诱导的AIH小鼠模型,研究发现,Pigr-KO小鼠比野生型小鼠表现出更严重的肝脏损伤、肠道菌群失衡和抗菌肽Reg3b分泌减少。这表明pIgR在维持组织完整性和肠道菌群平衡方面起着至关重要的作用。研究还揭示了pIgR通过STAT3依赖机制调节IL-17介导的炎症和免疫反应。当通过腺病毒载体AAV7阻断STAT3信号时,pIgR的保护作用被消除,表明STAT3在pIgR调节IL-17信号途径中发挥关键作用。此外,pIgR通过调节IL-17途径、促进固有淋巴细胞ILC3分化、诱导抗菌肽和调节肠道菌群组成来预防肠道源性脂多糖从肠道到肝脏的转移,从而保护AIH。
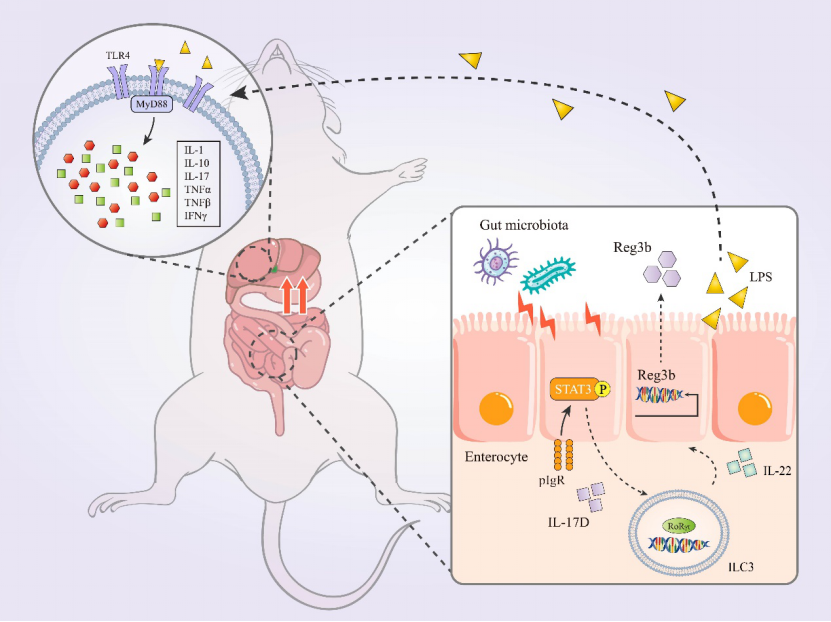
图2 文章机制图。
本研究在现有研究基础上进一步提出了pIgR在调节肠道菌群和肠道免疫系统中的作用,为基于“肠-肝”轴治疗AIH的治疗策略提供了新思路。论文链接:(https://www.sciencedirect.com/science/article/pii/S2095809924000353)